Le droit des brevets, reconnu en France depuis 1791 comme un droit de propriété industrielle, protège l’innovation technique, c’est-à-dire « tout produit ou procédé qui apporte une solution technique à un problème technique donné »[i].
Ce droit a été institué pour récompenser les apports de l’inventeur, par le versement d’une redevance temporaire ou permanente, et encourager l’industrie. En s’attachant plus particulièrement à l’étude des brevets dans le domaine pharmaceutique, on observe une certaine tension entre, d’un côté la propriété des inventions pharmaceutiques par l’inventeur et, de l’autre, la politique de santé publique et plus largement le droit à la santé des personnes. Cette dualité justifie la tendance longue, de 1844 à 1959, pendant laquelle la France a exclu les médicaments du droit des brevets. C’est la loi du 5 juillet 1944 qui vint clarifier cette situation en prévoyant à son article 3 que : « Ne sont pas susceptibles d’être brevetés, les compositions pharmaceutiques ou remèdes de toutes espèces ». Cette tension explique également la mise en place de systèmes « originaux » d’appropriation des inventions pharmaceutiques par l’État entre 1810 et 1850, puis le régime du visa[ii] appliqué entre 1941 et 1959. Lorsque le droit des brevets pour les médicaments a été autorisé par l’ordonnance du 4 février 1959 prévoyant la création d’un Brevet Spécial de Médicaments (SBM), le Parlement prévoyait la mise en place d’un régime spécifique. Ce dernier justifiait que : « Le médicament ne peut être assimilé à tous les produits de l’industrie ; sa protection, sa qualité, son prix, intéressent étroitement la santé publique »[iii]. Il faudra attendre la loi du 2 janvier 1968 pour que cette conception sociale des produits pharmaceutiques soit abrogée au profit de l’application du droit commun des produits brevetables.
La procédure traditionnelle suivie pour les brevets pharmaceutiques est telle que, dès qu’un « candidat médicament » prometteur est identifié, des demandes de brevet sont déposées. Après une étape pré-clinique sur des animaux, les « candidats médicaments » (hormis les vaccins) sont testés en trois phases d’essais cliniques sur l’homme . Longtemps à la pointe de l’innovation dans ses secteurs de prédilection, la France ne parvient pas à se trouver une place dans ce système en pleine mutation. En effet, ces dernières années, l’industrie pharmaceutique a connu des progrès majeurs en matière de biotechnologies, rendant le processus d’innovation plus complexe et plus coûteux.
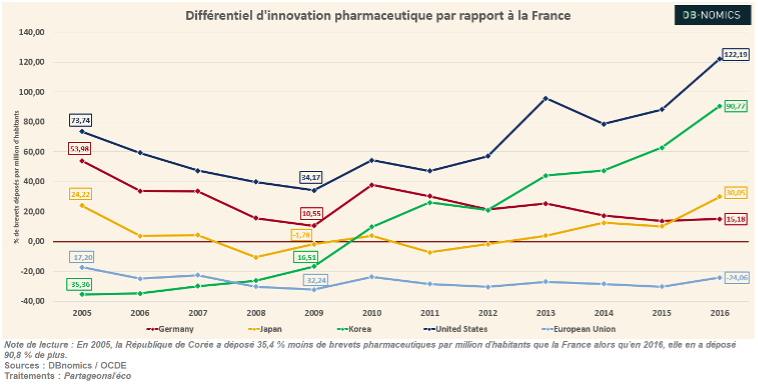
En comparaison avec certains de ses voisins européens et surtout avec les États-Unis, la République de Corée ou encore le Japon, la France accuse un retard significatif qui tend à se creuser. Si l’insuffisance de financements publics alloués à la recherche fondamentale constitue l’une des explications possibles à ce retard, la politique de gouvernance du processus d’innovation jugée trop rigide constitue un autre frein conséquent. En effet, le brevet constitue un élément essentiel de l’écosystème de l’innovation et la longue réticence à son instauration dans la sphère des découvertes pharmaceutiques n’a pas permis de répondre efficacement aux enjeux de santé publique. Le graphique ci-dessus rend compte, sur la période 2005-2016, de l’écart progressif entre la France et les pays leaders en termes d’innovations pharmaceutiques, mesurées par le nombre de brevets déposés divisé par le nombre d’habitants. Alors qu’en 2005, la République de Corée déposait 35,4 % moins de brevets pharmaceutiques par million d’habitants que la France, en 2016, elle en déposait 90,8 % de plus. Cette distanciation se retrouve également en prenant pour comparaison les États-Unis avec lesquels la France accuse un écart grandissant de plus de 120 %.
Pour comprendre en partie ce pourquoi la France peine à s’intégrer durablement et efficacement dans ce paysage en perpétuelle mutation, il convient de s’attarder sur les différentes composantes du processus d’innovation pharmaceutique. Par exemple, les essais cliniques, parties intégrantes du processus d’innovation, pouvent constituer un réel avantage pour le pays dans lequel ils sont réalisés. En effet, qu’il s’agisse d’un avantage pour les patients en termes d’accès aux nouvelles thérapies, pour les médecins en matière d’expérience ou plus généralement, pour l’ensemble de la société en matière de connaissances et de progrès, les essais cliniques constituent de véritables avantages comparatifs. Or, si la France se distingue par un nombre conséquent d’essais, ces derniers ont trop souvent des normes scientifiques faibles, c’est-à-dire ne faisant preuve de suffisamment de lien entre la prise du médicalement et l’état de santé.
Si les vaccins à ARN messager de Pfizer-BioNTech et de Moderna contre le Covid-19 ont été développés puis mis sur le marché en moins d’un an, tous les deux reposent sur plusieurs brevets.
Or, considérant l’insuffisance de la production de vaccins, ne vaudrait-il pas envisager de libérer les brevets sur ces produits ? La « licence d’office » constitue l’un des leviers juridiques qui permettrait à des laboratoires concurrents d’exploiter les brevets de vaccin contre le Covid-19 qu’ils n’ont pas développés. Cependant, la procédure est lourde : elle nécessiterait un arrêté du ministre de l’économie, qui ne pourrait intervenir qu’après concertation auprès des titulaires des brevets et négociation pour régler la question du prix de leur rachat. D’autres solutions pourraient être envisagées pour s’affranchir de la contrainte des brevets : suspension temporaire des brevets, négociation de transferts de licences entre laboratoires, pression sur les laboratoires pour accorder des licences à un coût raisonnable… Mais encore faut-il que la levée des contraintes liées aux brevets suffise pour produire plus ?
Chloé Coudray
[i] Définition de l’Insee
[ii] Le régime de visa était une un système d’autorisation de mise sur le marché des spécialités pharmaceutiques. Il combinait le contrôle, la fabrication, l’évaluation du l’utilité thérapeutique du remède et d’appréciation de la nouveauté du produit.
[iii] Ordonnance du 4 février 1959 cité par Michel de Haas, Brevet et médicament en droit français et européen.